การกัดกร่อน
ความหมายของการกัดกร่อน (Corrosion) และการกัดเซาะ (Erosion)
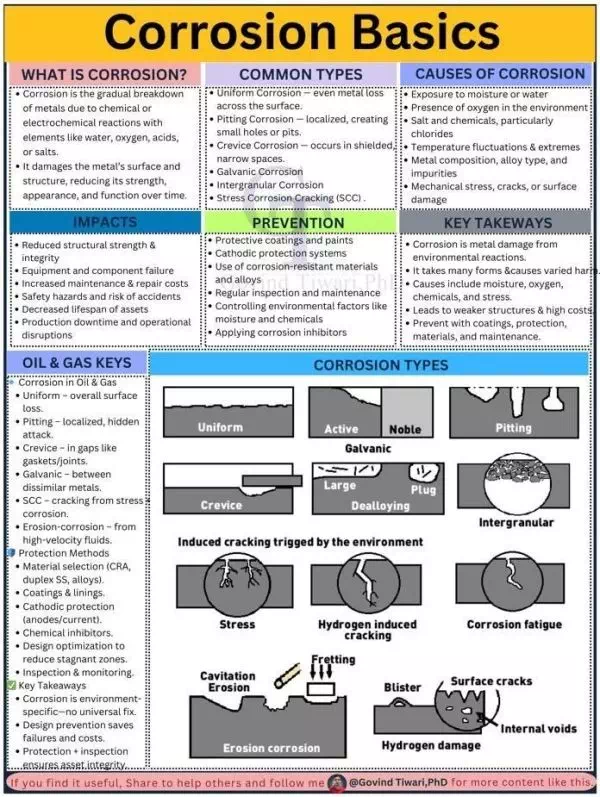
ลักษณะของการกร่อนแบบต่างๆ

การเกิดสนิมในท่อ
การกัดกร่อน (Corrosion)
- คำจำกัดความ:
การกัดกร่อนคือปฏิกิริยาเคมีหรือปฏิกิริยาไฟฟ้าเคมีระหว่างวัสดุ (โดยทั่วไปคือโลหะ) กับสภาพแวดล้อมของมัน ซึ่งนำไปสู่การเสื่อมสภาพของวัสดุอย่างช้า ๆ กระบวนการนี้มักเกี่ยวข้องกับการที่วัสดุทำปฏิกิริยากับออกซิเจน ความชื้น กรด หรือสารเคมีอื่น ๆ - ตัวอย่าง:
สนิมที่เกิดบนเหล็ก, การหมองของเงิน, การเกิดคราบเขียว (patina) บนทองแดง
การกัดเซาะ (Erosion)
- คำจำกัดความ:
การกัดเซาะคือการที่วัสดุถูกขจัดออกจากพื้นผิวโดยการกระทำทางกล เช่น การกระแทกของอนุภาคของแข็ง หยดของเหลว หรือการไหลของของเหลวที่มีความเร็วสูง ต่างจากการกัดกร่อนตรงที่การกัดเซาะเป็นกระบวนการทางกายภาพล้วน ๆ - ตัวอย่าง:
ใบพัดกังหันที่สึกหรอจากไอน้ำความเร็วสูง, การกัดเซาะของตลิ่งแม่น้ำจากการไหลของน้ำ, การกัดเซาะของดินจากลม
ความแตกต่างที่สำคัญ
- ลักษณะ: การกัดกร่อนเป็นกระบวนการทางเคมี ส่วนการกัดเซาะเป็นกระบวนการทางกล
- สาเหตุ: การกัดกร่อนเกิดจากปฏิกิริยาเคมี ส่วนการกัดเซาะเกิดจากแรงทางกายภาพ
การกัดกร่อนไม่ใช่แค่ “สนิม” – แต่มันคือการสลายตัวของโลหะอย่างช้าๆ อันเกิดจากปฏิกิริยาเคมีหรือไฟฟ้าเคมี กับความชื้น ออกซิเจน เกลือ หรือสารเคมีต่างๆ มันค่อยๆ กัดกินความแข็งแรง รูปลักษณ์ และการทำงานของชิ้นส่วนโดยไม่รู้ตัว
ปฏิกริยาในกระบวนการ การเกิดสนิม
โลหะทุกชนิดกัดกร่อนหรือไม่
โลหะที่อยู่ในลำดับปฏิกิริยา (reactivity series) สูง เช่น เหล็ก สังกะสี จะเกิดการกัดกร่อนได้ง่าย ในขณะที่โลหะที่อยู่ล่างในลำดับ เช่น ทอง แพลทินัม และพาลาเดียม จะไม่กัดกร่อน สาเหตุคือการกัดกร่อนเกี่ยวข้องกับการออกซิเดชันของโลหะ ซึ่งโลหะที่มีศักย์การออกซิเดชันต่ำมากจะไม่ถูกออกซิไดซ์ง่าย
สิ่งที่น่าสนใจก็คือ อะลูมิเนียม แม้จะเป็นโลหะที่มีความว่องไวในการทำปฏิกิริยา แต่กลับไม่เกิดการกัดกร่อนเหมือนโลหะอื่น เนื่องจากผิวอะลูมิเนียมถูกปกคลุมด้วยชั้นฟิล์มอะลูมิเนียมออกไซด์ ซึ่งทำหน้าที่ปกป้องจากการกัดกร่อนเพิ่มเติม
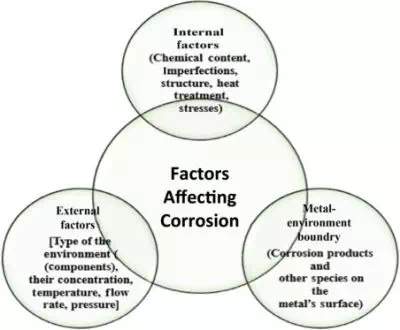
ปัจจัยที่มีผลต่อการกัดกร่อน (Factors Affecting Corrosion)
- การสัมผัสกับอากาศที่มีแก๊ส เช่น CO₂, SO₂, SO₃ เป็นต้น
- การสัมผัสกับความชื้น โดยเฉพาะน้ำเกลือ ซึ่งจะเร่งอัตราการกัดกร่อน
- การมีสิ่งเจือปน เช่น เกลือ (เช่น NaCl)
- อุณหภูมิ: อุณหภูมิที่เพิ่มขึ้นทำให้อัตราการกัดกร่อนสูงขึ้น
- ลักษณะของชั้นออกไซด์แรกที่เกิดขึ้น: บางชนิด เช่น Al₂O₃ จะสร้างชั้นป้องกันที่ไม่ละลายน้ำและช่วยป้องกันการกัดกร่อนต่อไป แต่บางชนิด เช่น สนิม จะร่วนแตกง่าย ทำให้เนื้อโลหะด้านในสัมผัสกับบรรยากาศและถูกกัดกร่อนต่อ
- การมีกรดในบรรยากาศ: กรดสามารถเร่งการกัดกร่อนให้เกิดขึ้นได้ง่าย
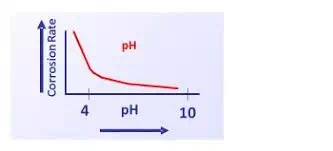
ความเป็นกรด/ด่างสัมพันธ์กับการเกิดการกัดกร่อน
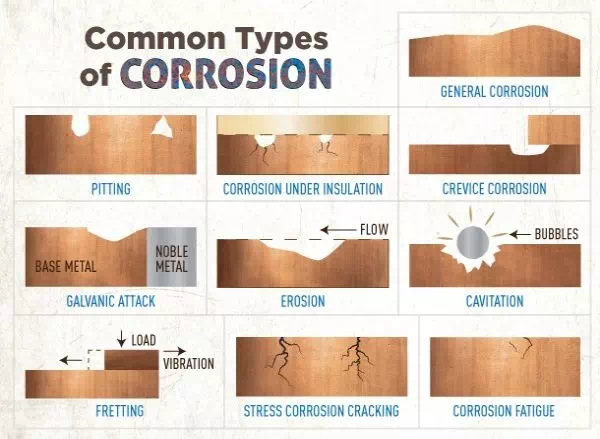
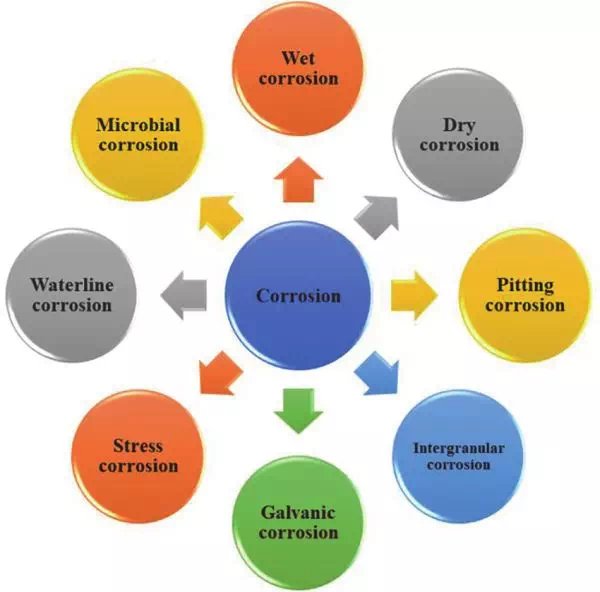
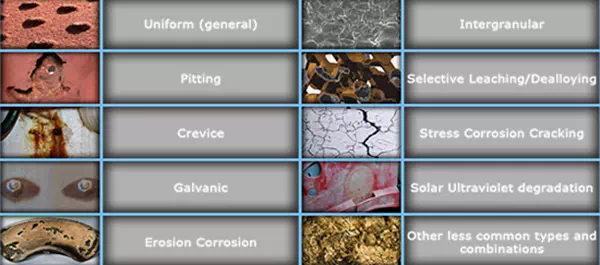
ประเภทของการกัดกร่อนที่พบบ่อย
ชนิดของการกัดกร่อน
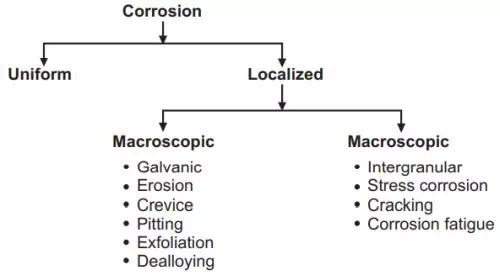
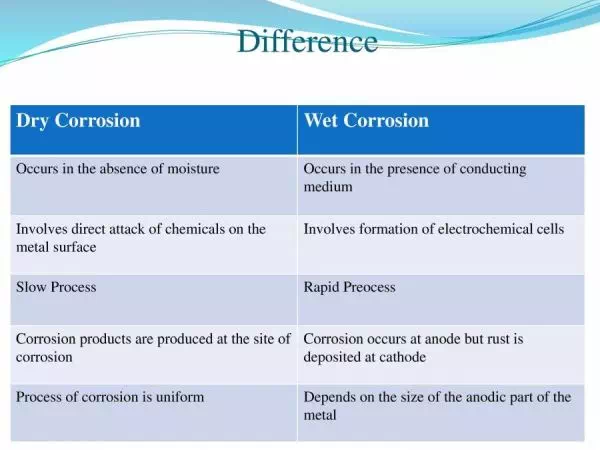
ความแตกต่างของการกัดกร่อนแบบแห้งและแบบเปียก
- การกัดกร่อนแบบสม่ำเสมอ (Uniform Corrosion) – ผิวโลหะสูญเสียอย่างทั่วถึง
- การกัดกร่อนแบบเป็นรู (Pitting Corrosion) – เกิดเป็นรูเล็กๆ ในจุดเฉพาะ
- การกัดกร่อนในรอยแคบ (Crevice Corrosion) – เกิดในจุดอับ แคบ หรือบริเวณที่อากาศไม่ถ่ายเท
- การกัดกร่อนแบบกัลวานิก (Galvanic Corrosion) – ระหว่างโลหะต่างชนิดที่สัมผัสกัน
- การกัดกร่อนระหว่างแนวผลึก (Intergranular Corrosion) – เกิดตามแนวขอบเกรนของโลหะ
- การแตกร้าวจากการกัดกร่อนและความเครียด (SCC) – เกิดรอยแตกร้าวจากแรงดึงและสภาพแวดล้อมที่กัดกร่อน
รูปแสดงการกัดกร่อนชนิดต่างๆ
ประเภทของการกัดกร่อนและการป้องกัน (Corrosion Types and Prevention)
ประเภทของการกัดกร่อนและการป้องกัน
พื้นฐานของการกัดกร่อน ตั้งแต่ปฏิกิริยาเคมีพื้นฐานไปจนถึงประเภทของสภาพแวดล้อมที่สามารถเกิดการกัดกร่อนได้ เนื่องจากการกัดกร่อนมักเกิดในสภาพแวดล้อมที่มีน้ำ (Aqueous environments) ในที่นี้จะกล่าวถึงประเภทต่าง ๆ ของการเสื่อมสภาพที่โลหะสามารถประสบได้ในสภาวะเช่นนี้
1. การกัดกร่อนแบบสม่ำเสมอ (Uniform Corrosion)
เป็นการกัดกร่อนที่เกิดขึ้นทั่วทั้งผิวของวัสดุอย่างสม่ำเสมอ และถือเป็นประเภทที่พบได้บ่อยที่สุด นอกจากนี้ยังจัดว่าไม่รุนแรงมากนัก เพราะสามารถประเมินขอบเขตของการกัดกร่อนได้ง่าย และผลกระทบต่อสมรรถนะของวัสดุก็สามารถวิเคราะห์และทดสอบซ้ำได้อย่างสม่ำเสมอ การกัดกร่อนประเภทนี้มักเกิดในพื้นที่กว้างของผิววัสดุ
2. การกัดกร่อนแบบเป็นหลุม (Pitting Corrosion)
การกัดกร่อนแบบเป็นหลุมถือว่าเป็นหนึ่งในประเภทที่ร้ายแรงที่สุด เพราะตรวจพบยาก คาดการณ์ยาก และวิเคราะห์ลำบาก เป็นการกัดกร่อนเฉพาะจุด โดยจุดแอโนด (หรือจุดแคโทด) ที่มีขนาดเล็กจะเกิดเป็นเซลล์กัดกร่อนร่วมกับผิวปกติรอบข้าง เมื่อหลุมเริ่มขึ้น มันจะลึกลงไปกลายเป็น “รู” หรือ “โพรง” ซึ่งมีรูปร่างหลากหลาย โดยทั่วไปหลุมจะลึกลงในแนวตั้งจากผิววัสดุ สาเหตุอาจเกิดจากฟิล์มออกไซด์ที่ป้องกันผิวเสียหาย หรือจากความไม่สม่ำเสมอในโครงสร้างของโลหะ การกัดกร่อนแบบหลุมเป็นอันตรายเพราะสามารถทำให้โครงสร้างพังทลายได้ แม้จะมีการสูญเสียเนื้อโลหะเพียงเล็กน้อย
3. การกัดกร่อนในรอยแยก (Crevice Corrosion)
การกัดกร่อนในรอยแยกเป็นการกัดกร่อนเฉพาะจุดเช่นกัน มักเกิดในสภาพแวดล้อมที่นิ่ง โดยมีความแตกต่างของความเข้มข้นของไอออนระหว่างสองพื้นที่ เช่น ใต้หัวน็อต ปะเก็น หรือแหวนรอง ซึ่งมีการจำกัดออกซิเจน พื้นที่เหล่านี้มักอนุญาตให้สารกัดกร่อนเข้าสู่ภายในได้ แต่มีการหมุนเวียนไม่เพียงพอ ทำให้ออกซิเจนหมดไป และไม่สามารถสร้างฟิล์มป้องกันใหม่ได้ เมื่อสารละลายนิ่งเพิ่มขึ้น ค่าพีเอช (pH) ก็จะเปลี่ยนไปจากความเป็นกลาง ซึ่งทำให้การกัดกร่อนรุนแรงขึ้น การออกแบบข้อต่อที่ดีสามารถช่วยลดปัญหานี้ได้
4. การกัดกร่อนตามแนวเขตผลึก (Intergranular Corrosion)
เมื่อพิจารณาโครงสร้างจุลภาคของโลหะ จะพบว่าโลหะประกอบด้วยเม็ดผลึก (Grains) และแนวเขตระหว่างเม็ดผลึก (Grain boundaries) การกัดกร่อนตามแนวเขตผลึกมักเกิดจากสิ่งเจือปน หรือการเปลี่ยนแปลงองค์ประกอบของโลหะผสมตามแนวเขตเหล่านี้ ซึ่งสามารถส่งผลกระทบต่อคุณสมบัติเชิงกลของโลหะได้ แม้เนื้อโลหะส่วนใหญ่ยังคงสภาพดีอยู่
ตัวอย่างคือ การตกตะกอนของคาร์ไบด์ ซึ่งเกิดเมื่อโลหะได้รับความร้อนสูง (เช่น 800°F – 1650°F) หรือบริเวณที่มีการเชื่อม ในสเตนเลสสตีล คาร์บอนจะทำปฏิกิริยากับโครเมียมเกิดเป็นคาร์ไบด์ ทำให้ปริมาณโครเมียมลดต่ำกว่า 11% ซึ่งเป็นค่าที่จำเป็นในการสร้างชั้นออกไซด์ป้องกันอย่างอัตโนมัติ โลหะเกรด 304L และ 316L ที่มีคาร์บอนต่ำ จึงให้ความต้านทานการกัดกร่อนในรูปแบบนี้ได้ดีกว่า
5. การแตกร้าวจากการกัดกร่อนภายใต้ความเค้น (Stress Corrosion Cracking – SCC)
SCC เกิดจากการรวมกันของความเค้นแบบดึง (Tensile stress) และสภาพแวดล้อมที่กัดกร่อน มักเกิดในอุณหภูมิสูง ความเค้นอาจมาจากภายนอก เช่น แรงดึงจริง หรือจากการเปลี่ยนแปลงอุณหภูมิอย่างรวดเร็ว หรืออาจเป็นความเค้นตกค้างจากกระบวนการผลิต เช่น การรีดเย็น การเชื่อม การกลึง การเจียร ฯลฯ โดยทั่วไปพื้นผิวภายนอกจะยังดูสมบูรณ์อยู่ แต่ภายในจะเกิดรอยแตกร้าวขนาดเล็กในโครงสร้างจุลภาค ซึ่งยากต่อการตรวจพบ รอยร้าวมักมีลักษณะแตกหักแบบเปราะ และขยายในทิศทางตั้งฉากกับแนวความเค้น การเลือกใช้วัสดุที่เหมาะสมกับสภาพแวดล้อมและควบคุมความเค้น สามารถช่วยป้องกันความเสียหายร้ายแรงได้
6. การกัดกร่อนแบบกัลวานิก (Galvanic Corrosion)
เป็นการกัดกร่อนที่เกิดขึ้นเมื่อโลหะสองชนิดที่มีศักย์ไฟฟ้าแตกต่างกันสัมผัสกันในสภาพแวดล้อมที่เป็นตัวนำไฟฟ้า เช่น น้ำเกลือ ตัวอย่างเช่น ทองแดงสัมผัสกับเหล็กในน้ำทะเล แม้ว่าจะมีเงื่อนไขครบทั้งสาม (โลหะต่างชนิด, สัมผัสกัน, และมีอิเล็กโทรไลต์) แต่ยังมีปัจจัยอื่นที่ส่งผล เช่น อุณหภูมิ และผิวสัมผัส การเลือกใช้โลหะที่อยู่ใกล้กันในตารางกัลวานิก (Galvanic Series) ช่วยลดความเสี่ยงจากการกัดกร่อนประเภทนี้
ในสภาพแวดล้อมที่มีน้ำ โลหะอาจประสบกับการกัดกร่อนหลายรูปแบบ เช่น การกัดกร่อนแบบสม่ำเสมอ แบบเป็นหลุม แบบในรอยแยก ตามแนวเขตผลึก จากความเค้น และแบบกัลวานิก ผลิตภัณฑ์ที่ทำจาก สเตนเลสสตีล (Stainless Steel) จึงมักถูกเลือกใช้เพื่อต้านทานการกัดกร่อนเหล่านี้ เนื่องจากองค์ประกอบทางเคมีที่เหมาะสม ช่วยให้ต้านทานสารกัดกร่อนได้ดี ขณะที่ยังมีราคาถูกกว่าโลหะพิเศษอื่น ๆ เช่น ไทเทเนียมหรือ Inconel®
- สเตนเลสเป็นเหล็กกล้าคาร์บอนต่ำที่มีโครเมียมอย่างน้อย 11% ซึ่งเมื่อสัมผัสกับออกซิเจน จะเกิดชั้นฟิล์มออกไซด์แบบพาสซีฟที่ช่วยป้องกันการกัดกร่อน และสามารถฟื้นฟูตัวเองได้
- นิกเกิล (Nickel) ช่วยเสถียรโครงสร้างและเพิ่มความต้านทานต่อ SCC
- แมงกานีส (Manganese) เมื่อใช้ร่วมกับนิกเกิล จะช่วยป้องกันการกัดกร่อนแบบเป็นหลุม
- โมลิบดีนัม (Molybdenum) ซึ่งพบในเกรด 316 จะเพิ่มความต้านทานต่อการกัดกร่อนในรอยแยกและแบบเป็นหลุม
- คาร์บอนต่ำ เช่น ใน 304L และ 316L ช่วยลดความเสี่ยงของการกัดกร่อนตามแนวเขตผลึก
- ไนโตรเจน แม้จะไม่ใช่ส่วนประกอบหลัก แต่ก็ช่วยเพิ่มความต้านทานต่อการกัดกร่อนแบบเป็นหลุมได้อีก
การเลือกใช้สเตนเลสสตีลอย่างเหมาะสม สามารถลดความเสี่ยงจากการกัดกร่อนได้อย่างมาก และช่วยลดต้นทุนในระยะยาวจากการซ่อมหรือเปลี่ยนอุปกรณ์ที่ชำรุดก่อนเวลาอันควร
สาเหตุหลักของการกัดกร่อน:
- การสัมผัสกับความชื้นและออกซิเจน
- การสัมผัสกับเกลือและสารเคมี (โดยเฉพาะคลอไรด์)
- อุณหภูมิที่สูงหรือต่ำเกินไป
- องค์ประกอบของโลหะและสิ่งเจือปน
- ความเสียหายทางกล (เช่น รอยร้าว แรงเครียด การกระแทก)
มาตรฐานสากลที่เกี่ยวข้องกับการกัดกร่อน:
- API 571 – กลไกความเสียหายที่มีผลต่ออุปกรณ์ในอุตสาหกรรมการกลั่น
- API 651 / API 652 – การป้องกันด้วยกระแสไฟฟ้าและการบุถังเก็บของเหลวเหนือดิน
- ISO 12944 – การป้องกันสนิมของโครงสร้างเหล็กด้วยระบบการพ่นสี
- ISO 9223–9226 – การจัดประเภทสภาพแวดล้อมที่มีผลต่อการกัดกร่อน
- NACE MR0175 / ISO 15156 – วัสดุที่ใช้ในสภาพแวดล้อมที่มี H₂S (ไฮโดรเจนซัลไฟด์)
- NACE SP0169 – การควบคุมการกัดกร่อนภายนอกของท่อโลหะที่ฝังใต้ดินหรือจมอยู่ในของเหลว
กลยุทธ์ในการป้องกันการกัดกร่อน:อ
- ใช้สารเคลือบ สี และสารยับยั้งการกัดกร่อน
- ใช้การป้องกันด้วยกระแสไฟฟ้า (Cathodic Protection) ตามแนวทางของ NACE / ISO
- เลือกวัสดุหรือโลหะผสมที่ทนการกัดกร่อน
- ตรวจสอบและบำรุงรักษาอย่างสม่ำเสมอ ตามมาตรฐาน API และ ISO
- ควบคุมปัจจัยแวดล้อม เช่น ความชื้นและสารเคมี
สาระสำคัญที่ควรจำ:
- การกัดกร่อนสามารถนำไปสู่การพังทลายของโครงสร้าง อุบัติเหตุ และค่าใช้จ่ายในการซ่อมแซมมหาศาล
- การปฏิบัติตามมาตรฐานสากล ช่วยรับประกันความปลอดภัย ความน่าเชื่อถือ และการปฏิบัติตามข้อกำหนด
- การป้องกันที่ได้ผล ต้องอาศัยการออกแบบที่ดี การเลือกวัสดุที่เหมาะสม และวัฒนธรรมการดูแลรักษาที่มีวินัย
ต้องมั่นใจว่าการป้องกันการกัดกร่อนได้ถูกรวมอยู่ในแผนงานโครงการและการบำรุงรักษา โดยต้องอ้างอิงตามมาตรฐาน และตรวจสอบอย่างมีระบบ
การกัดกร่อนอุตสาหกรรมและปิโตรเลียม
- การกัดกร่อนของท่อที่ฝังใต้ดิน
- จะป้องกันการกัดกร่อนใต้ดินได้อย่างไร
- เรียนรู้วิธีป้องกันการกัดกร่อนของท่อที่ฝังใต้ดิน
ท่อที่ฝังอยู่ใต้ดินต้องเผชิญกับสภาพแวดล้อมที่รุนแรงมาก เช่น:
- ความชื้นสูง
- ดินและเกลือที่เชื่อมโยงกัน
- กระแสไฟฟ้ารั่ว
- และบางครั้งพื้นดินที่นำไฟฟ้าไม่ดี
วิธีป้องกันการกัดกร่อนของท่อที่ฝังใต้ดิน:
- การป้องกันด้วยกระแสไฟฟ้า (Cathodic Protection)
➤ ระบบ CP จะช่วยป้องกันท่อจากการกัดกร่อน โดยการควบคุมทิศทางของกระแสไฟฟ้าเพื่อป้องกันกระบวนการออกซิเดชัน - การเคลือบผิวภายนอกคุณภาพสูง
➤ เช่น โพลีเอทิลีน – อีพ็อกซี – บิทูเมน
การเคลือบผิวเป็นแนวป้องกันด่านแรก ต้องมีความสมบูรณ์ 100% - การทดสอบค่าความต้านทานของดิน (Soil Resistivity Tests)
➤ เพื่อตรวจสอบความรุนแรงของดินก่อนการฝังท่อ - การตรวจสอบเป็นระยะโดยใช้เทคนิค NDT (Non-Destructive Testing)
➤ เช่น DCVG – CIPS – Intelligent Pigging
เพื่อเฝ้าระวังความปลอดภัยของท่อใต้ดิน
รอยขีดข่วนบนผิวสี + ดินที่มีฤทธิ์กัดกร่อนสูง = จุดเริ่มต้นของการกัดกร่อนจริง ที่อาจคุกคามระบบทั้งหมด
การกัดกร่อนร้อนชนิดที่ II (Type II hot corrosion) เกิดขึ้นที่อุณหภูมิระหว่าง 600 ถึง 850 °C และเกี่ยวข้องกับซัลเฟตของโลหะพื้นฐาน (base-metal sulfates) ซึ่งต้องการความเข้มข้นของก๊าซซัลเฟอร์ไตรออกไซด์ (SO₃) เพื่อความเสถียร เมื่อซัลเฟตเหล่านี้คงตัวแล้ว จะทำปฏิกิริยากับโลหะอัลคาไล ทำให้เกิดเกลือที่มีจุดหลอมเหลวต่ำ และขัดขวางการสร้างชั้นออกไซด์ป้องกัน
อัตราการกัดกร่อน (Rate of Corrosion)
แบบจำลอง Deal–Grove มักถูกใช้ในการอธิบายการก่อตัวของชั้นออกไซด์ ซึ่งช่วยในการทำนายและควบคุมการก่อตัวของออกไซด์ในสถานการณ์ที่หลากหลาย
นอกจากนี้ ยังมี วิธีการวัดด้วยการสูญเสียน้ำหนัก (Weight loss method) โดยนำโลหะหรือโลหะผสมที่สะอาดและชั่งน้ำหนักไว้ไปสัมผัสกับสภาวะแวดล้อมที่ก่อให้เกิดการกัดกร่อนในช่วงเวลาหนึ่ง จากนั้นจึงทำความสะอาดเพื่อลบสารที่เกิดจากการกัดกร่อนออก แล้วชั่งน้ำหนักอีกครั้งเพื่อหาน้ำหนักที่สูญเสียไป
สูตรการคำนวณอัตราการกัดกร่อน (R):
- k = ค่าคงที่
- W = ค่าน้ำหนักที่โลหะสูญเสียไปในเวลา t
- A = พื้นที่ผิวโลหะที่สัมผัส
- ρ = ความหนาแน่นของโลหะ (g/cm³)
ตัวอย่าง ปฏิกิริยา และผลกระทบจากการกัดกร่อน (Corrosion Examples, Reactions and Effects)
1. การกัดกร่อนของทองแดง (Copper Corrosion)
ทองแดงเมื่อสัมผัสอากาศจะทำปฏิกิริยากับออกซิเจนกลายเป็น Cu₂O (สีแดง) และต่อมาออกซิไดซ์เป็น CuO (สีดำ) ซึ่งจะทำปฏิกิริยากับ CO₂, SO₃ และ H₂O ในอากาศ กลายเป็นสารประกอบ เช่น มาลาไคต์ (สีฟ้า) และโบรชานไทต์ (สีเขียว)
👉 ตัวอย่างที่เห็นชัดคือ สีเขียวของ เทพีเสรีภาพ (Statue of Liberty)
2. การหมองคล้ำของเงิน (Silver Tarnishing)
เงินทำปฏิกิริยากับกำมะถันในอากาศ กลายเป็น Ag₂S (สีดำ) เช่นที่เกิดกับเงินที่สัมผัสกับก๊าซ H₂S จากกระบวนการอุตสาหกรรม
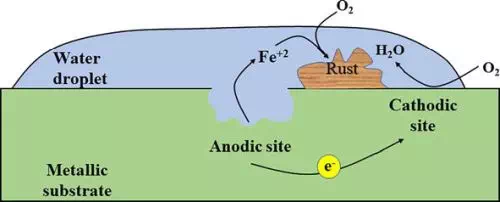
3. การเกิดสนิมเหล็ก (Rusting of Iron)
เป็นตัวอย่างที่พบมากที่สุด เมื่อเหล็กสัมผัสกับน้ำหรืออากาศ จะเกิดปฏิกิริยาอิเล็กโทรเคมี โดย Fe จะเสียอิเล็กตรอนกลายเป็น Fe²⁺ แล้วถูกออกซิไดซ์ต่อไปเป็น Fe³⁺ สุดท้ายก่อให้เกิดสนิม Fe₂O₃·xH₂O
เมื่อเหล็ก (iron) สูญเสียอิเล็กตรอน มันจะเปลี่ยนไปเป็น Fe²⁺ (Fe{aq}²⁺) ซึ่งถือว่าเป็นตำแหน่งขั้วแอโนด (anode) อิเล็กตรอนที่สูญเสียไปจะเคลื่อนที่ไปยังอีกด้านหนึ่ง ซึ่งจะรวมตัวกับไอออน H⁺ โดย H⁺ เหล่านี้ถูกปล่อยออกมาจากน้ำ (H₂O) หรือกรดคาร์บอนิก (H₂CO₃) ที่มีอยู่ในบรรยากาศ (ถือว่าเป็นตำแหน่งแคโทด cathode)
ไฮโดรเจนที่เกิดขึ้นจากปฏิกิริยาระหว่าง H⁺ และอิเล็กตรอน จะทำปฏิกิริยากับออกซิเจนเพื่อสร้างน้ำ (H₂O)
ปฏิกิริยาแอโนด (Anode reaction):
2Fe(s) → 2Fe²⁺ + 4e⁻
ปฏิกิริยาแคโทด (Cathode reaction):
(รวมกับ H⁺ และ O₂ → H₂O)
ปฏิกิริยารวม (Overall reaction):
2Fe(s) + O₂(g) + 4H⁺(aq) → 2Fe²⁺(aq) + 2H₂O(l)
E°cell = 1.67 V
ไอออน Fe²⁺ ที่เกิดขึ้นที่ขั้วแอโนดจะทำปฏิกิริยากับออกซิเจนในบรรยากาศ กลายเป็น Fe³⁺ และสร้าง Fe₂O₃ ซึ่งปรากฏออกมาในรูป ไฮเดรต (hydrated form) คือ Fe₂O₃·xH₂O (สนิม)
Fe²⁺ + 3O₂ → 2Fe₂O₃
Fe₂O₃ + xH₂O → Fe₂O₃·xH₂O
ตัวอย่างอื่นของการกัดกร่อน
- การกัดกร่อนของสังกะสี (Zinc) เมื่อทำปฏิกิริยากับออกซิเจนและ HCl จะเกิด ZnCl₂ สีขาว
- การกัดกร่อนของดีบุก (Tin) จะเกิดสาร Na₂[Sn(OH)₂] สีดำ
การกัดกร่อนก่อให้เกิดผลกระทบหลากหลายประการ โดยหลัก ๆ คือ ทำให้สิ้นเปลืองทรัพยากรธรรมชาติ และยังอาจก่อให้เกิดอันตรายร้ายแรง เช่น
- โครงสร้างอาคารอ่อนแอและไม่มั่นคง
- อุบัติเหตุจากชิ้นส่วนที่ผุกร่อน
- ความเสียหายร้ายแรง เช่น ท่อแตกร้าว สะพานพังถล่ม ยานพาหนะเกิดอุบัติเหตุ หรือภัยพิบัติอื่น ๆ
ดังนั้น จึงจำเป็นต้องมีการตรวจสอบและป้องกันการกัดกร่อนอยู่เสมอ
การป้องกันการกัดกร่อน (Prevention of Corrosion)
การป้องกันการกัดกร่อนมีความสำคัญอย่างยิ่งเพื่อลดการสูญเสีย เนื่องจากโครงสร้างส่วนใหญ่ที่เราใช้งาน เช่น สะพาน รถยนต์ เครื่องจักร ของใช้ในบ้าน (ประตู-หน้าต่างเหล็ก ราวเหล็ก รางรถไฟ ฯลฯ) ล้วนทำจากโลหะ และมักสัมผัสกับสิ่งแวดล้อม เช่น ความชื้น น้ำทะเล กรด หรือสารเคมีอื่น ๆ
วิธีการป้องกันที่นิยมใช้ ได้แก่:
- การชุบด้วยไฟฟ้า (Electroplating)
- การชุบสังกะสี (Galvanization)
- การทำอโนไดซ์ (Anodization)
- การทำให้เกิด passive film (Passivation)
- การเคลือบด้วยชีวะฟิล์ม (Biofilm coatings)
- การเคลือบสารกันสนิม (Anti-corrosion protective coatings)
- การทาสีหรือทาจาระบี (Painting and greasing)
- การใช้สารยับยั้งการกัดกร่อนหรือสารดูดความชื้น (Corrosion inhibitors or drying agents)
- การทำความสะอาดผิวโลหะอย่างสม่ำเสมอ
วิธีการป้องกันการกัดกร่อน (How to Prevent Corrosion)
การป้องกันการกัดกร่อนแต่ละประเภทเป็นสิ่งสำคัญในการรักษาการทำงานและยืดอายุการใช้งานของชิ้นส่วนและอุปกรณ์ต่างๆ
การป้องกันเชิงรุก เช่น การเคลือบผิว การเคลือบป้องกัน หรือการตกแต่งพื้นผิววัสดุ เป็นวิธีที่ดีในการลดผลกระทบของการกัดกร่อน
ในด้านการจัดการน้ำเสีย ความเสี่ยงที่เกี่ยวข้องกับการกัดกร่อนสามารถลดลงได้ด้วยการใช้ระบบอย่างเช่น ระบบบำบัดน้ำเสียแบบมีฟิล์มชีวภาพเคลื่อนที่ (MBBR – Moving Bed Biofilm Reactor) ระบบนี้ใช้ตัวพา (carriers) ที่มีฟิล์มชีวภาพ ซึ่งนอกจากจะช่วยในกระบวนการบำบัดน้ำเสียอย่างมีประสิทธิภาพแล้ว ยังช่วยยืดอายุการใช้งานของส่วนประกอบที่อยู่ใต้น้ำ โดยลดจำนวนจุลินทรีย์ที่ทำให้เกิดการกัดกร่อน
แต่มาตรการที่ง่ายที่สุดในการป้องกันการกัดกร่อนส่วนใหญ่ คือการ เลือกใช้วัสดุที่ทนการกัดกร่อน และหลีกเลี่ยงสภาพแวดล้อมที่กัดกร่อนได้
ภาคผนวก
บทสรุปย่อทางวิชาการของการกัดกร่อน